塩酸の電離と電離式まとめ【中3理科】


そこで用いるのが、酸であるクエン酸です。 酸を HA として、水 H 2 O と酸塩基反応させると、次のような化学反応式が書けます。
12例 1) 弱酸とその塩の混合水溶液(酢酸と酢酸ナトリウム) 酢酸は弱酸なので平衡状態で電離し,酢酸ナトリウムは完全に電離している(塩の電離度は 1)。
さらに、リン酸一水素イオンは、3度目の電離で水素イオンとリン酸イオンになります。
水酸化バリウム• 水素イオンというと,暗にオキソニウムイオンH 3O +を意味します。
代表的な難溶性塩として塩化銀 AgClがある。
しかし、酢酸 CH 3 COOH と酢酸ナトリウム CH 3 COONa の混合水溶液に強酸や強塩基を少量加えても、 pH の変化は小さいです。
このようなある温度 T において、一定の値を取る式を得ることができます。
アンモニアの酸化体としてはやなどがある。
ここから少しややこしい式になりますが、平衡時の濃度を文字を使って表せるようになればそれほど難しくはありません。


しかし、その電離は必ずしも一気に進むわけではなく、少しずつ段階的に電離が進みます。
それ故に、塩化水素 HCl が電離する平衡は右に傾き、強い酸として働くことになるのです。
塩基の強弱を決めているのは、水酸化物イオンOH -です。

05 のときの電離度となります。 そのときの、水素は通常の水素原子に比べても小さいために、水素結合の結合角は180度に近くなります。 水素イオンやを出す力が大きくないので、あまり電離をしません。
1デンマークのブレンステッドとイギリスのローリーは,1923年にそれぞれ独自にプロトンの授受で定義しています。
これは滴定によって酢酸ナトリウムが生じ,未反応の酢酸と共に緩衝溶液となっているためである。


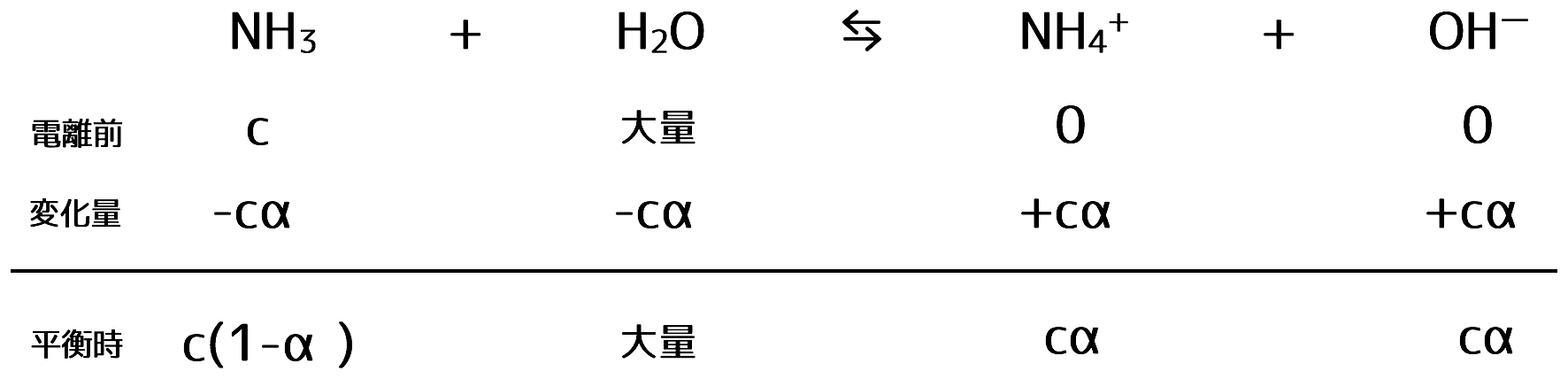
それぞれを別々に水に溶かしてから混ぜれば、CaCO3の沈殿が生じるよく知られた反応が起こります。 ) よって、近似後の反応後の組成は次のようになります。 アンモニア NH 3 と塩化アンモニウム NH 4 Cl は、水溶液中では次のように電離しています。
1したがって,水素イオンが0.0016mol,酢酸イオンも0.0016molです。
要は、「電気陰性度の大きい原子に結合した水素と、電気陰性度の大きい原子の間の静電的な引力」です。

強酸と弱酸の違いについて、特別研究員の宮本 一弘 先生(開成学園中学・高等学校 教諭)に詳しく解説していただきました。 このように、同じ酸でも、いろいろな状態があり得ます。
アンモニアを何モラーにしたら希望のpHになるか計算のしかたを教えてください。
第1段の電離が最も起こりやすく,第2段,第3段となるにしたがって電離は急激に起こりにくくなります。

極めて可燃性又は引火性の高いガス• 【緩衝溶液と pH】 純水に少量の酸や塩基を加えると,その水溶液の pHは大きく変化するが, 弱酸とその塩または弱塩基とその塩の混合水溶液に酸や塩基が少量加わっても pHはほとんど変化しない。 CH 3COONH 4• 上の電離平衡の電離定数を表す式は下のようになる。 ですから,ブレンステッド・ローリーの定義では,~として作用する,~としてはたらくというような表現になります。
2009年8月10日閲覧。
そのため, OH -が残り塩基性を示す。