モル濃度・質量パーセント濃度・質量モル濃度!濃度計算のコツも解説! │ 受験メモ


もう一つ質量で方程式を立てる例題を出しておきます。 【答】16. モル濃度は、 溶液1Lに溶けている溶質の物質量(mol)で表した濃度です。 計算が多段階になるというのはこういうことです。


もう一つ質量で方程式を立てる例題を出しておきます。 【答】16. モル濃度は、 溶液1Lに溶けている溶質の物質量(mol)で表した濃度です。 計算が多段階になるというのはこういうことです。
水の場合は、質量と体積(容積)は同じです。
水酸化ナトリウム1Lには1. 72 Kg。

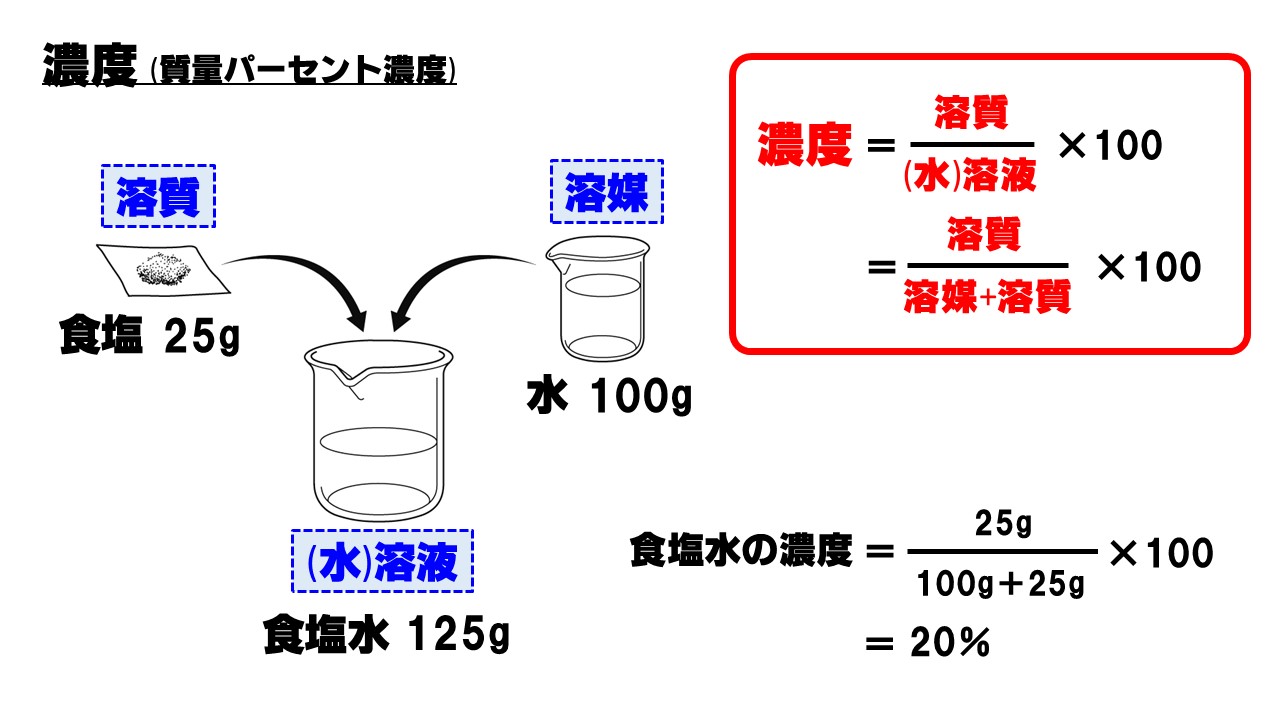
食塩水なら、 食塩が 溶質です。
%という「濃度」で方程式を立てることはほとんど(全くといって良いほど)ありません。
濃度の定義を正確に理解するためには、 「 溶媒・溶質・溶液」の意味を正確に理解する必要があります。


溶液に溶けている溶質(この問題の場合は塩酸)は12. なぜなら、濃硫酸中の硫酸の量と希硫酸中の硫酸の量は変わらないからです。
13これを求める具体的な公式は以下のような形となります。
「 溶質」は、 水などに溶けている物質のことでした。
装置の設計を行っているものですが、相談できる人がいなく、大変困っております。 これで単位は揃ったので、 あとは計算するだけですね。 ぜひマスターしてください。
8まず、必要な濃硫酸をx[mL]とおきます。
このとき、 溶質と溶液の単位がgであることに注意しなければなりません。
質量モル濃度とは、溶質の物質量[mol]を溶 媒の質量[ kg]で割ったものです。
。
おわりに アンケートにご協力ください!. よろしくお願いいたします。
このときできた砂糖水は何gか。
問題は予想できますよ! スラスラできるまで繰り返せば、 高得点が狙えるのです。
溶質、溶媒、溶液 水に食塩を溶かしたものを食塩水という。
1:モル濃度とは?質量パーセントとの違いもわかる! まずは、モル濃度とは何かについて解説します。
中学理科では、問題文等で当たり前のように「溶質」「溶媒」「溶液」という言葉が使われます。


質量パーセント濃度を求める方法は、わかりましたか? 次は 水溶液の濃度を求める計算問題に取り組んでいきますので、自信がない人はもう一度見直しておきましょう。
102 今回は周期表の解説です。
密度は体積あたりの質量を表します。