エビデンスとは何か。証拠・根拠との意味合いの違いについて|アタリマエ!

ここで、各選択肢の研究デザインを解説します。


ここで、各選択肢の研究デザインを解説します。
医師であろうと専門家個人の意見であり、極端なことを言えば体験談でしかありません。
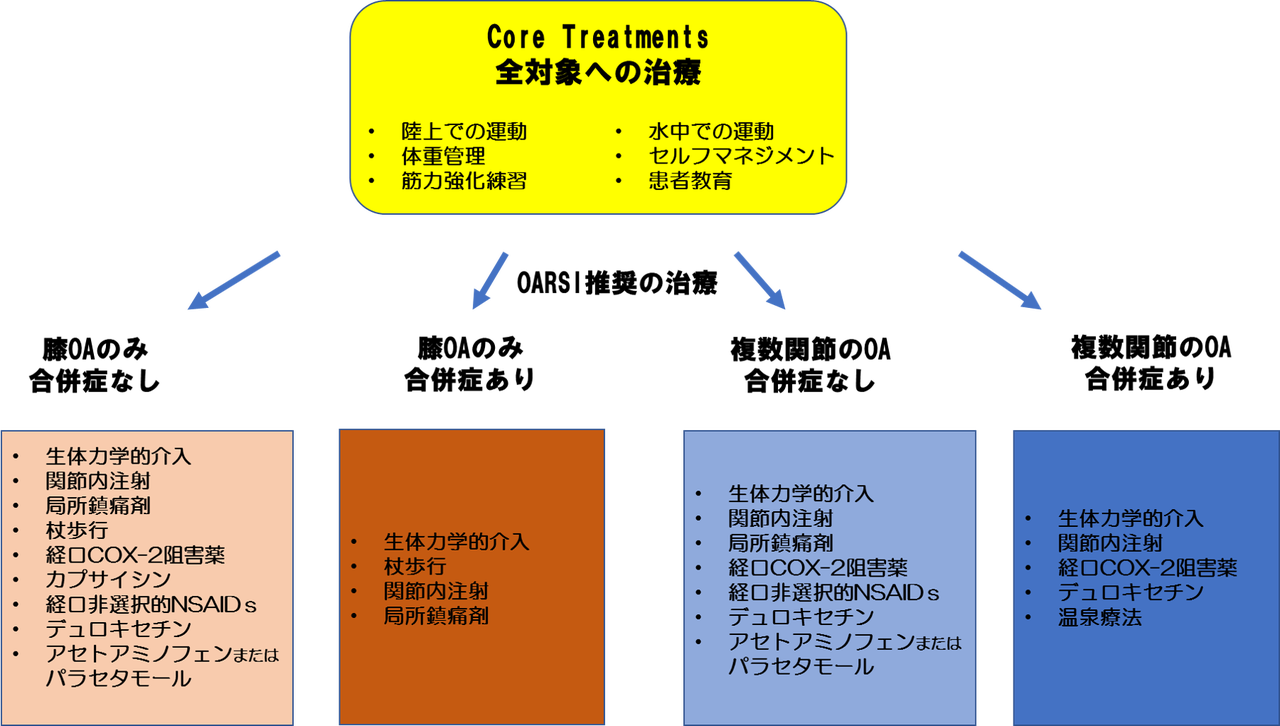
2)ガイドラインが取り扱う健康上の問題が具体的に記載されている。
病気の患者さんを症例、病気のない人を対照というため、症例対照研究と呼びます。 EBMにまつわる誤解 [ ] 過去のEBM教育ではこのStep1〜3の方法論を研ぎ澄ませることに重きを置き、またStep4については必ずしも言葉で説明を尽くされて来なかったことから、医療者の中には「良い臨床研究を見つけて医療をマニュアル化することがEBMである」との誤解が広まった時期がある。 実際のところ、認知バイアスは数え上げればきりがありません。
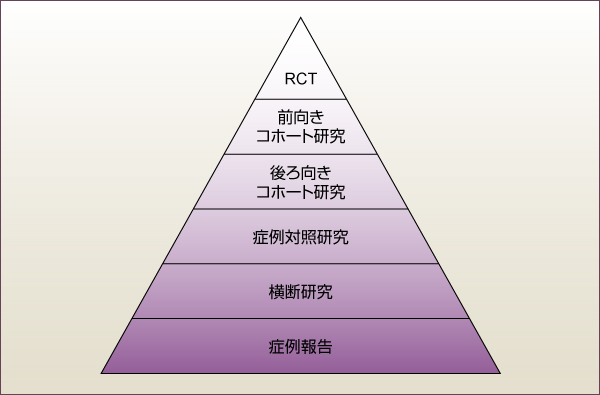
2a:ランダム割付を伴わない同時コントロールを伴うコホート研究(前向き研究)とは、 対象集団のランダム性には乏しいが、介入グループと非介入グループの比較はやっていてその後の追跡調査も行われた研究と言えます。
医療に対して何か情報を入手した際、その情報は本当に正しいと言えるのか、その裏付けとなる「科学的根拠」があるかどうか、を確認する必要があります。
栄養素は競合して働き、人によって必要な栄養が異なります。
公表されている論文の中から、複数のランダム化比較試験(1b)の結果を、まとめて再解析するものです。
システマティック・レビュー 医学雑誌や学会発表などから臨床試験の報告を集め、その内容を評価し、要約してまとめたものです。
常に「その情報はエビデンスがあるのか」批判的になれるようになりましょう。

症例集積研究 (しょうれいしゅうせきけんきゅう) ケースシリーズ研究ともいいます。 評価では各項目を得点化し、「推奨する」「推奨する(条件付き)」「推奨しない」などの全体評価をするものの、AGREE共同研究の公式見解では、得点自体はガイドライン比較の際の意思決定の道具などとして使い、合格点を定めて「合格」「不合格」といった使い方はすべきではないとしている。 EBMはこのように、通常行われている診療行為を科学的な視点で再評価(「批判的吟味」と呼ばれる)したうえで、患者の問題を解決する手法と位置づけられ、外部の(=科学的根拠)を目の前の患者にどのように適用するかに最も関心がある。
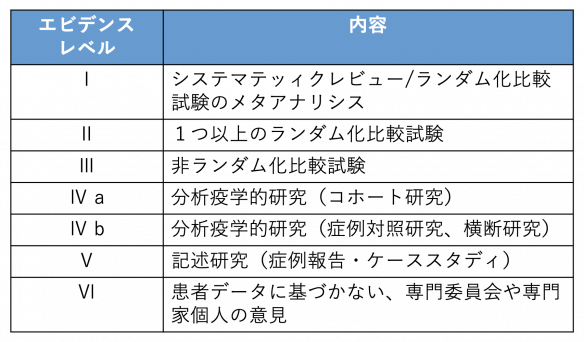
エビデンスレベルは、• 臨床状況と環境• これに対して、を重視する医学では、一定の目的を達成する手段として医学を一つの技術とみなす。
薬Aが疾患Xに効果があるのか?ということを証明したい時には一人の研究者だけのデータよりも複数の別々の研究者たちのデータから出た結論のほうが信頼できますよね?もしかしたらある研究者は効果有りといっても他の研究者は効果なしという結論を出している可能性もあるのです。

EBM診療ガイドラインの公開(日本医療機能評価機構、厚生労働科学研究費補助金)• これらの内容について、少し詳しく説明していきます。
原則として、コホート研究は介入をせず、観察のみで行われる研究。
22 エビデンスはどのようにして出されているのか? エビデンスとはいきなり出されるものではありません。


一方、病弱な人は頻繁に病院に通うため、小さな癌でも発見され、癌であると診断されることがあります。 経験したことのある人は少ないと思いますが「治験」というアルバイトがあります。 領域 3.作成の厳密さ 7)エビデンスを検索するために系統的な方法が用いられている。
2そこまで極端ではなくとも、どんな薬を使っていたか、普段どんな生活をしているか、どんな持病があるかといった背景によって、別の人でも同じ結果が得られるとは限りません。
Step2:定式化した問題を解決する情報の検索• 評価項目のすりかえは無いか?• 専門家が細胞・分子または動物実験を根拠に使うときは、エビデンスレベルは強くないと考えます。
最後に「コホート研究」です。
これらの複数の情報を考慮し、患者さんと共に考えて意思決定することがEBMの原則です。