ギブズエネルギー、自発的な反応

つまり、 K Xは 定温・定圧(P=一定) に於ける各X iの変化に関してのみ定数となる。 原本は下記のURLからpdfファイルとしてダウンロードできます。 それが幸せということかどうか解りませんが。
11
つまり、 K Xは 定温・定圧(P=一定) に於ける各X iの変化に関してのみ定数となる。 原本は下記のURLからpdfファイルとしてダウンロードできます。 それが幸せということかどうか解りませんが。
11実際、この反応の熱化学方程式は、から と表されるので、この解離反応は吸熱反応です。
ただし、 は部分系を示す。
「はじめて学ぶ科学史」p89-92 山中康資 共立出版 2014年9月25日初版1刷• そこの結論から1モルのアンモニアが生成する反応 の任意温度(標準圧力)における反応エンタルピー変化は でした。
これらもギブズ-ヘルムホルツの式と呼ばれる。
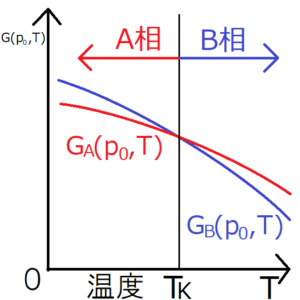

位置エネルギーも同様に位置演算子の関数に置き換えられる。 平衡定数K PはP B/P Aであるから が得られる。 その当たりの関係をまとめると下図の様になる。
その詳細はやを参照。
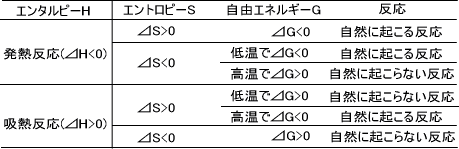
ギブズエネルギーGは、反応の方向を予測するために導入された熱力学的関数であり、エンタルピーH、絶対温度T、エントロピーSで表される。
すなわちによる直接測定が困難な反応熱は、起電力やの温度依存性を測定することにより、間接的に測定できる。 1 Vと算出されます。
6逆に正の値だと、維持しようとするエネルギーの方が大きいことになりますから変化は進みません。
復習のためにを繰り返すと でしたから、前記の値を代入すると となる。
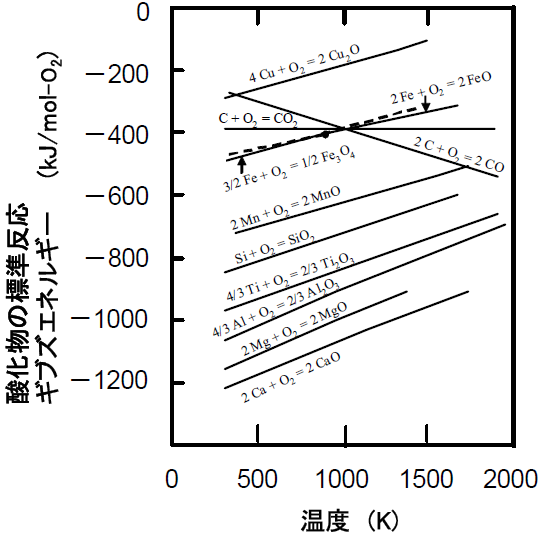
つまり、log eK P=-(-16. このPは当然不活性ガスの分圧と水蒸気の分圧の和です。 例えば上記のピストン容器に1molの水素と1/2molの酸素の混合物を1atmの下で封入した場合を考えてみよう。
17アンモニア合成は人類の繁栄に重大な影響を与えたが、同時に多くの悲劇をもたらした。
これも肥料の原料として世界中に輸出されます。

一定圧力下で不活性ガスを添加する場合。 所が、一つまみの白金海綿触媒を加えると反応は瞬時に進行して水蒸気となる。 カロリーには様々な定義があるが、日本のでは 熱化学カロリー thermochemical calorie が用いられている。
しかし、それを使うためには、系のエントロピーの変化と外界のエントロピーの両方の総和を考えなければいけません。
492であることが観測から解っている。