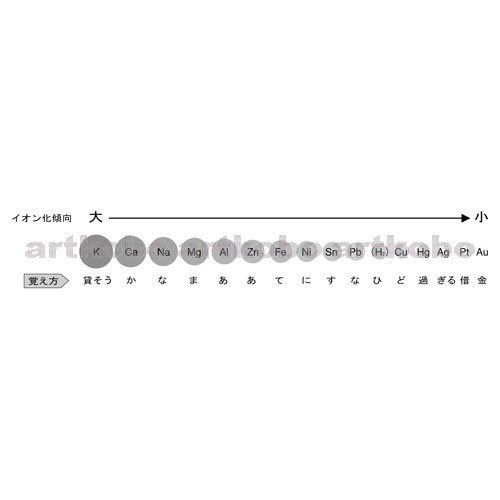
イオン化傾向は語呂で覚える Li K Ca!


これら三つの金属は濃硝酸には溶けません。 熱濃硫酸の場合には二酸化硫黄、濃硝酸の場合には二酸化窒素、希硝酸の場合には一酸化窒素を発生して溶け、硫酸塩や硝酸塩の水溶液となります。


これら三つの金属は濃硝酸には溶けません。 熱濃硫酸の場合には二酸化硫黄、濃硝酸の場合には二酸化窒素、希硝酸の場合には一酸化窒素を発生して溶け、硫酸塩や硝酸塩の水溶液となります。
前回の記事では, イオン化傾向を利用して電気が流れるようにした仕組みのことを電池といい,電気分解は電池に繋いでビリビリと電気を流すことで分解が起こる仕組みのことをいうのでした. このことは• そして、 の左側はが多くを占めているんでした。
例題として、次の水溶液とそれに浸す金属の組み合わせで金属が溶けるかどうか、溶けるのであればその化学反応式を答えてみましょう。

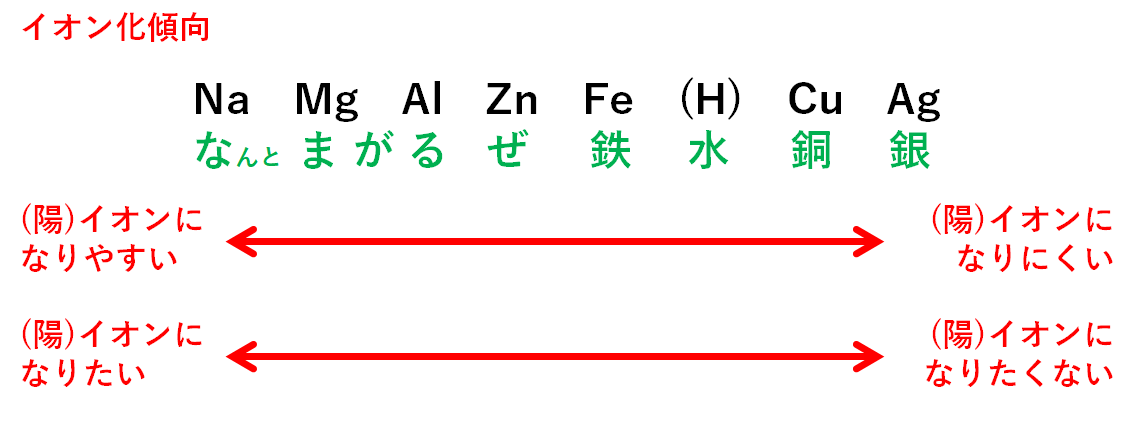
それに比べて、右側の金属は逆に『 還元しやすい』つまり、すぐに金属に戻ってしまいます。 になりやすいのは、の右側と左側どちらでしたか? そうです、 の左側がになりやすいんでしたね。 水素がイオンでいる状態より、金属がイオンになって電子を渡す側になる方が強い傾向になるからです。
7上の イオン化列をみると、『 アルミニウム』はイオン化列の左側で、右側にある『 銀』に比べて、より電子 - を手放して陽イオンになりやすいことがわかります。
この反応の式は次のようになります。

マグアルアエンテツドウ イオン化傾向ですが、実は中学生でここまで覚えてもあまり意味がありません。 つまり、ネオンの電子配置に近づこうとイオン化した時には、電子を1個手放し陽イオンとしてナトリウムイオンになります。
15どう思いますか。
との距離が遠いほど中心からの引力が弱まるので、電子殻が多いほど、中心からの引力は弱い。


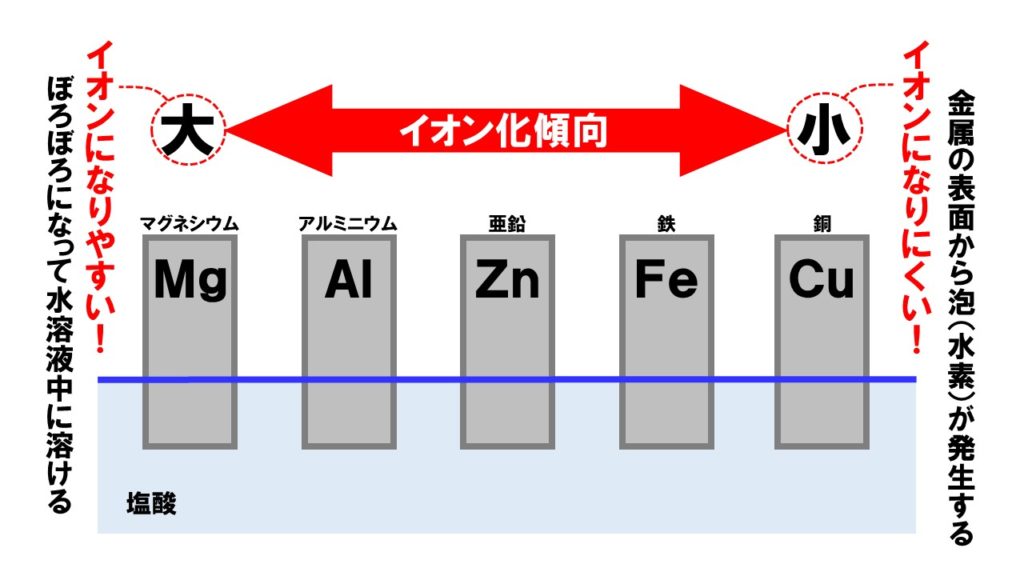
左側の金属ほどイオンになりやすく、右側に行くにつれてイオンになりにくくなっています。 二種類の金属のうち、イオン化傾向が大きいほう 図中のZn で電子を放出する酸化反応が起こり、陽イオンが水溶液中に溶け出します。
ご使用の際は内容が正しいかどうか、本当に役に立つかどうかをご自分でご確認ください。
イオン化傾向と酸化還元反応 1 電池 イオン化傾向とは イオンになりたい気持ち順に元素を左から並べたものだと説明しました。
ここまでを改めて書いてみると、 一番右の金属元素は、還元しやすいので、加熱するだけで金属に戻ってしまうという訳です。
陽子は8個で変わらないのに対し、電子は10個に増加したため、二つだけマイナスが多くなり、O 2-となります。

最終的に、F(9番)と原子番号が最も近い希ガスのNe(10番)と同じ電子配置となります。 ここで確認して欲しいのが の大小関係 = 反応性の大小関係 だということ。
最終的に、Na(11番)と原子番号が最も近い希ガスのNe(10番)と同じ電子配置となります。
になりやすい、それはつまり、電子を放出しやすい(=電子が原子から外れやすい)ということを意味します。

化学電池のしくみ 化学変化を利用して、化学エネルギーを電気エネルギーに変換する装置を 「 化学電池」といいます。 融解塩電解については後に詳しく学びますが、それ程難しいものではないので、その大まかな意味はつかんでおきましょう。 よく考えてみてください。
18逆に負極に同じものを使うときは、正極のイオン化傾向が低いほうが大きな起電力を示します。
定期テストでもイオン化傾向は覚えておくように出題されますが、センター試験でも同じです。
あれです。
このページでは イオン化傾向について解説しています。