阻害剤の反応速度論
活性部位を取り合うことで反応を阻害するとき、Vmaxは変わらないがKmを上げる。 実体は高分子か? 1902年 ブラウン(英)とアンリ(仏) スクラーゼの活性は酵素濃度に依存。
17

活性部位を取り合うことで反応を阻害するとき、Vmaxは変わらないがKmを上げる。 実体は高分子か? 1902年 ブラウン(英)とアンリ(仏) スクラーゼの活性は酵素濃度に依存。
17p -ニトロフェノールは発色するので吸光度を測定すると生成量が分かる。
また、本酵素の活性制御に重要な役割を果たす自己阻害ドメインの合成ペプチドを用いて図3や図5のような阻害実験を行うことにより、活性制御機構に関する重要な知見が得られている。

単純拡散と担体介在輸送の大きな違いは、特異的タンパク質が輸送に関わるかどうかである。 これらの酵素は複数の結合部位を有しており、阻害剤または活性化因子の結合によって活性が制御されます。 非常に一般的な不可逆的阻害の例は、アセチルコリンエステラーゼ(AChE)とジイソプロピルフルオロリン酸(DFP)の反応です。
7一方、阻害剤に比べて基質が十分に存在する場合でも、阻害剤は酵素に結合し反応を妨げることができますので、最大反応速度 Kmは阻害剤がないときに比べて小さくなります。
合成酵素 Ligase, Synthetase C-C, C-O, C-N結合 などの生成反応 (ATPを要求) DNAリガーゼ,アミノアシルtRNA合成酵素, アシルCoAシンテターゼ,カルボキシラーゼ群 補助因子: 活性を発揮するためにアミノ酸以外の成分( 補助因子)を必要とする酵素もある。

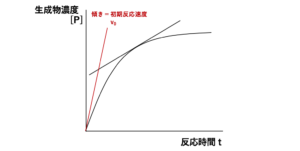
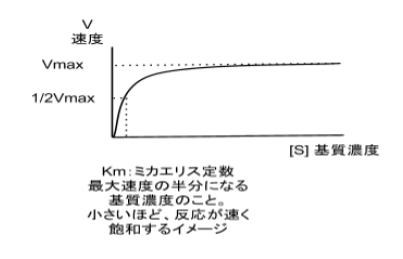
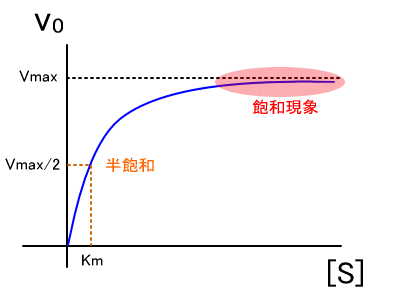
[S]が高くなるにつれ、漸近的にV maxに近づきます。 , The graphical determination of Km and Ki. 基質阻害• 受動輸送では、濃度の高い方から低い方へ物質が移行する。 ・非競合阻害 活性部位を奪い合わないが、別の部位に働いて酵素の働きを下げる。
17Sponsored Link ミカエリス・メンテンの式を用いると、反応速度論量(Km値とVmax)を決めることができますが、その前段階として、酵素反応速度の求め方を知っておく必要があります。
平衡とは 動的平衡であり、反応が止まっているわけではなく A と B は絶えず AB に転換しており逆も起きている。
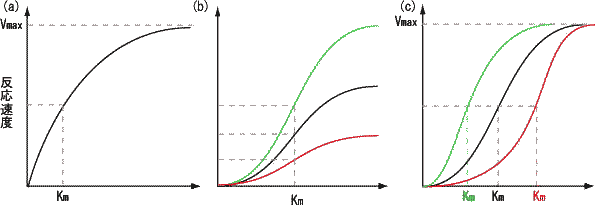

こうしたことから、反応速度( v)は、 Km値と基質濃度[S]の大小関係によって、次の3つの状況にわけて表すことができます。 すなわち、 Km値が小さいと、酵素と基質の親和性は高い ということになります。 3 阻害の形式 拮抗阻害 Competitive Inhibition ・阻害剤は基質と同じ部位に結合する阻害形式である。
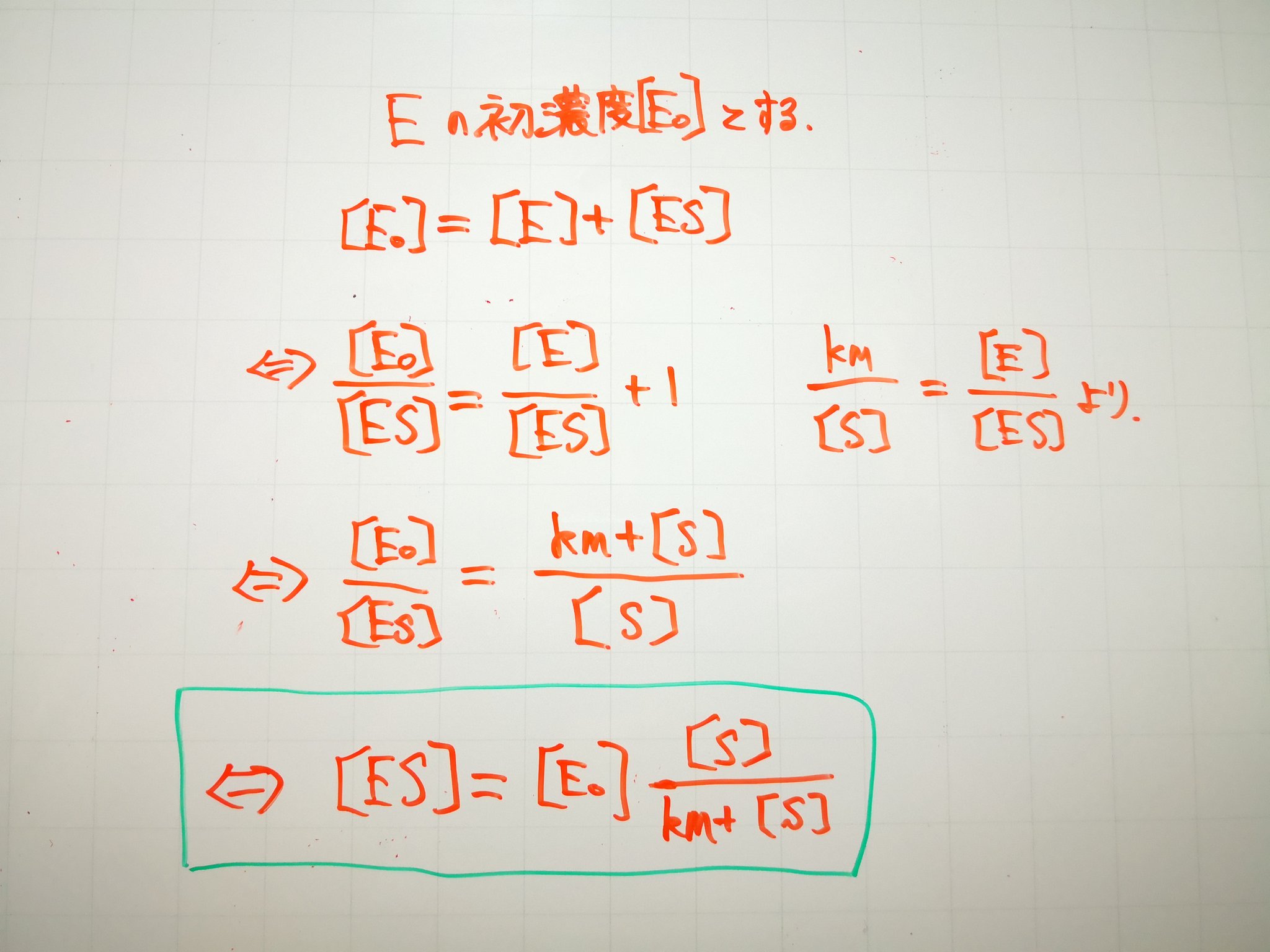
6共有結合した色素( 補欠分子族という): FAD, ヘム(類,カタラーゼ,ヘモグロビンなど),ビオチン,リポ酸など ビオチニル基(Lys残基に結合) リポイル基(Lys残基に結合)• ある基質Sが酵素Eと反応して生成物Pを得るとき、次の式が成り立つ。
非競合阻害 阻害剤の結合部位:基質と異なる酵素の部位 Kmの変化:変わらない Vmaxの変化:小さくなる 3.不競合阻害 阻害剤が、 酵素-基質複合体に結合することによって酵素反応を阻害するものを 不競合阻害といいます。

ミカエリス・メンテン式と反応速度論量の決定 (Km値とVmax)についてはこれで以上です。 実験によるパラメータの決定 [ ] 2つのパラメータ、 V max とミカエリス・メンテン定数 K m の値は実験ではやで求めることができる。
10Hendersonプロットによる阻害様式の判定は,基質濃度を増加した時の直線の傾きの変化で調べる(図9)。
(非競争阻害)• すると、次の式が成り立つ。
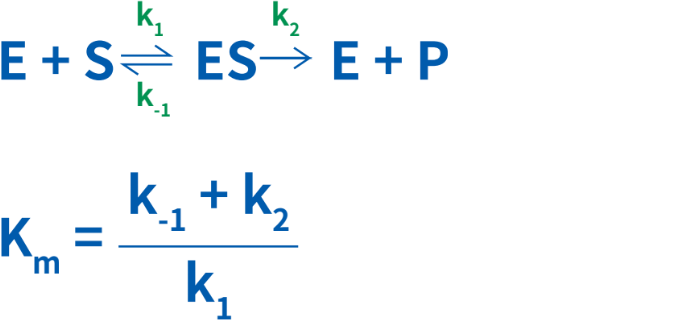
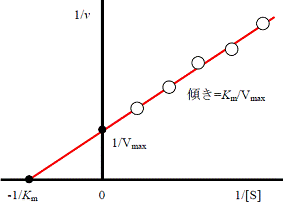
前述の両逆数プロットを使うとこれらを見分けることができる。
酵素の表面には基質が結合する溝状のくぼみがある。
それに対し、投与量を増加すると、血中濃度や尿中未変化体量が投与量に比例せず、消失速度定数や全身クリアランス、分布容積は投与量や血中濃度により変化することがある。


同じ基質に対して, K m が異なる酵素の場合, K m が小さいほど作用が強いといえる。同様に,同じ酵素に対して, K m が異なる基質の場合, K m が小さい基質ほど作用を受けやすいといえる。 酵素-基質複合体(ES)の解離定数 K S は次のように与えられる。
7よって、阻害剤がないときに比べ Km値が小さくなります。
それらの酵素は場合によっては単独でも働くが,多くの酵素はタンパク質以外の成分を必要とする()。
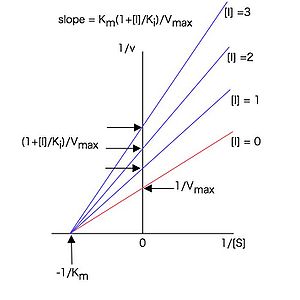
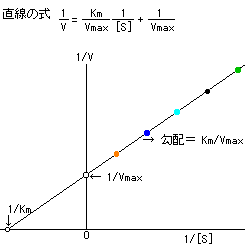
また,V maxは変わらず, K mだけが増加する。
Km値が小さいほど酵素と基質の親和性が高く、逆に Km値が大きいほど酵素と基質の親和性が低いことを意味します。
4 担体介在輸送(能動輸送、促進拡散) 担体介在輸送は、透過物質に対して選択性をもつトランスポータータンパク質が関与している。