酸化銀(化粧品):Cosmetic

特別要件施設と呼称する。

特別要件施設と呼称する。
熱以外にも、電気や光などでも物質を変化させることができます。
[Kr]は、電子が充満したクリプトンの電子配置です。


2化学反応は温度が高いほど速やかに進行する。 上の写真のように 酸化銀を試験管に入れて加熱をします。 つまり、100度温度が上がれば1000~59000倍に、 200度温度が上がれば100万倍~35億倍に早くなる。
7具体的には、物質にが化合する反応、あるいは、物質がを奪われる反応などである。
銀イオンの反応 銀イオンを含む溶液に塩基性溶液を加えると褐色の酸化銀が沈澱します。
貨幣としての利用 [ ] 詳細は「」を参照 銀の用途として古来より最も重要だったものは、としての利用である。 銅に比べて銀は原子番号が大きいので、d軌道以外にf軌道などもあり、外側に電子が出にくく1価が安定になります。
厚生省公示 20 号試験 食品容器安全性 社団法人 日本毛髪科学協会• AgNO 3• 11 に示します。
子孫たちの安全な生活を 今から考える事は必須かと存じます。


有 久光工房および参加企業は商品化、商業可能性、使用目的についての適切性に関する一切の保証責任を負いません。 mCPBA 関連項目 [ ]• タンパク質はアミノ酸からできていますが、そのアミノ酸成分と銀イオンとの反応も重要です。
12次の図は、小林敏勝、 表面科学、Vol. 銀が古くから支配階級や富裕階級に食器材料として用いられてきた理由の一つは、硫黄化合物や化合物などの毒を混入された場合に、化学変化による変色でいち早く異変を察知できる性質からという説がある。
この場合は、硝酸銀とアルカリ水酸化物によって で調製されることが多い。


しかし精錬の方法が向上してくるに従い、銀鉱石からの生産が増加して銀の価値は金に比べ低いものとなった。 変異原性試験 AMES テスト 財団法人 日本缶詰検査協会• これらは、金属水酸化物が水に溶けやすいので、強塩基性を示します。
17酸素と銀の化合物。
紙や木が燃えるのは炭化水素が酸素と反応し、二酸化炭素と水へと変化する酸化反応で、発生するエネルギーが大量な為、発光と発熱を伴う()。


2O 3• 酸化銀の毒性、副作用、安全性 酸化銀は、黄色ぶどう菌などのグラム陽性菌や大腸菌などのグラム陰性菌にとっては、細胞膜を破壊する毒となるが、人体に対しては、安全と言われている成分です。 水溶液は強いアルカリ性で、空気中から二酸化炭素を吸収する。 1836年にイギリスのダニエル(Daniell, John Frederic)は,ダニエル電池と呼ばれる電池を発明しました。
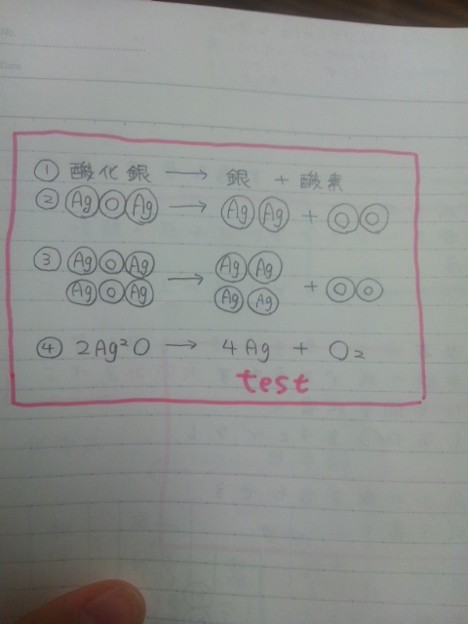
11KMnO 4• (基本的に、小さな数字は「その直前に書いてある原子」が何個あるのか、を表します) で、前に書いてある大きな数字は「そのパックが何個あるのか」を表すので、あなたの書いてあるように2(Ag2O)という解釈であっているのですよ。
中学2年生だということを考慮して、例を出して説明します。

では、どうしてアルミニウムを使うといいのでしょう。 硝酸に溶けやすい• () 2O 3• ほかにも、酸化剤は化学工業分野での応用範囲が広いほか、空気のない宇宙空間を飛ぶの燃料としても必須である。 勝手に変えることはできません。
12銀のスプーンが黒くなったのは、空気中に存在する微量の硫化水素のせいです。
バイ菌やウイルスの表面はマイナスの荷電を持っています。


まだ、イオンとかは習っていません(分解のところだけです)。 特にヨーロッパにおいては、の使用はステータスを示すものとされて珍重され、、、、、、その他多種多様な銀食器が製造された。
じつは、あの黒いものは硫化銀なのです。
300 世界の産出量トップ6の銀鉱山 鉱山 国 2010年産出量 Cannington銀・鉛・亜鉛鉱山 38. 既に#2の方が答えられていますので簡単に。


鉱山保安法により規定される特定施設(金属鉱業、原油・天然ガス鉱業に属する事業を営むものが有するものに限る) 2. 最後は塩化です。 2O 3• 不動態が生じると、本来反応すべき金属が反応しなくなり、酸や塩基に対して、極めて安定になります。 銀の単体 金の次に展性、延性に富んだ白色の金属で、『電気と熱の電導性が金属の中でも最も大きい物質』です。
5厚生労働省からはによるが推奨されているが、が不向きな水質も存在している。
この理由は、水に難溶な塩である塩化鉛 II PbCl 2 や硫酸鉛 II PbSO 4 が鉛 Pb の金属表面に生じて、反応がそれ以上進行しなくなるからです。