酸化力のある酸として、熱濃硫酸、濃硝酸、希硝酸、王水があげられますが、塩酸や希硫酸な

は鉄が酸化して生成した(赤褐色)で、銅が酸化すると、赤褐色のや黒色のが生成する。


は鉄が酸化して生成した(赤褐色)で、銅が酸化すると、赤褐色のや黒色のが生成する。
過マンガン酸の塩、クロム酸の塩、硝酸および硝酸塩ハロゲン、金属の塩、酸素および酸素をふくむ酸類・酸化物など非常に多くのものが酸化剤としてのはたらきをもっています。
ほかにも、酸化剤は化学工業分野での応用範囲が広いほか、空気のない宇宙空間を飛ぶの燃料としても必須である。
間接的な関係はある。
mCPBA 関連項目 [ ]• 体内には絶えず酸化物を摂取しているのです。


塩酸、水酸化マグネシウム、リン酸、酢酸、アンモニア、水酸化カリウム、水酸化鉄(III)、硫酸、シュウ酸、硝酸、 これらを2価の酸、1価の塩基、強酸に分類せよ、という問題なのですが まず、それぞれの化学式は書けます。 硝酸類 銀は空気中の酸素では酸化されませんが硝酸にあうと、酸化されて硝酸銀になります。 高校化学においての段階で示しておきます。
2今、早急に本来のバランスを取り戻すことが必要な時代になっております。
例えば、亜鉛 Zn を水素電極と接続すると、両極間の電位差は 0. 雷が落ちるのは、地上にプラスイオンが過多になり、空からマイナスイオンが降ってきて バランスを整えようとする働きです。

この測定値を見ると、おもしろいことが分かります。 」や「酸や酸化力の強い酸との反応」などは、いいのですが、「水蒸気と反応しやすい物質」や、「CやCOで還元される物質」というものの判断にイオン化傾向を用いて、理解させることに、若干のナンセンス感を感じます。
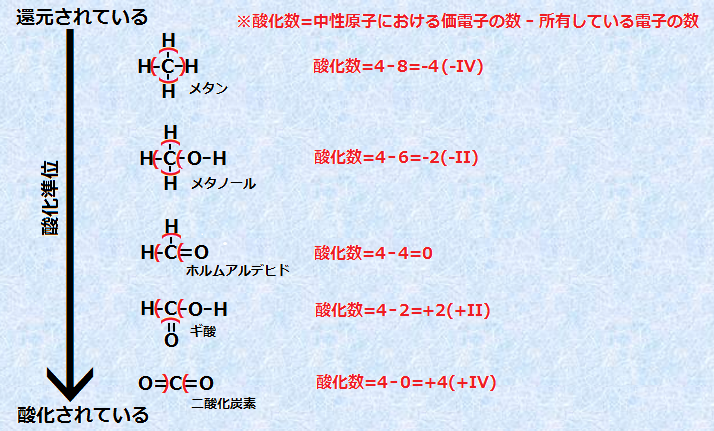
酸化というのは、「電子が奪われること」、「物質が酸素と化合すること」です。
しかし自然界の滝はどうでしょうか?自然界の良い水はどうでしょうか? だから、できるだけ自然の力だけで、 還元力を示したり、マイナスイオンを発生させたりすることが大事なのです。

逆に、(藍)のように酸化が発色や定着に重要な役割をする色素もある。 カルシウム Ca とナトリウム Na を比べたとき、昇華熱 Q 1 とイオン化エネルギー Q 2 こそ、 Ca > Na でナトリウム Na が有利ですが、水和熱 Q 3 は、 Ca >> Na でカルシウム Ca の方が圧倒的に有利なのです。 強酸性電解水は、以下のような用途に使われます。
4たとえば,イオン化傾向の大きいアルカリ金属元素の単体は,空気中でも速やかに酸化されて金属光沢を失います。
このように、強酸性電解水は安全性の点で非常に優れていますが、日持ちしないことや、タンパク質と反応して殺菌力が弱まってしまうこと、油脂に弾かれて消毒効果を発揮できないことなどが弱点です。

原子や分子から電子が1つなくなることを「酸化」といいます。 このような酸化力の強い酸としては、硝酸 HNO 3 や熱濃硫酸 H 2 SO 4 があります。 有機化学における酸化 [ ] では酸化反応は還元反応と並んで重要な反応の一つである。
8銅と銀を比較すると,銅の方が陽イオンになりやすいことから,銅は銀よりもイオン化傾向が大きいということができます。
マイナス120mVという還元電位を示しますが、その一方では、逆に強酸化電位を排水し、 環境を悪化させています。

この反応を利用して、水の中に有機物がふくまれているかいないかを調べることもできます。 酸化力のある酸というのは、水素イオンと対になっている部分のイオンに酸化力があるものを示します。
13過マンガン酸カリウム 黒紫色の棒状の結晶で水に溶かすと美しい紫色になります。
H 2O 2• 今回は四塩化炭素を2mL加えてみました。


カテゴリー• さて、本当に酸化力の強いものと反応して、やが生成されたの?と疑問に思うかもしれません。 後半の質問ですが、cmj25580さんの感じている違和感は もっともです。
この表. 酸化力とは反応物を酸化させる(電子を奪う)力があるものを表します。
代表的な金属の反応性を,表にまとめます。